南京2024年夏天晚上八点天黑了吗
2024-04-28
碳酸钾是由两个钾离子和一个碳酸根离子形成的无机化合物。它的化学式是K2CO3。它是一种吸湿的白色固体,换句话说,它很容易从环境中吸收水分。因此,在实验室里,它被用来从其他物质中吸收水分。它极可溶于水,
碳酸钾是由两个钾离子和一个碳酸根离子形成的无机化合物。它的化学式是K2CO3。它是一种吸湿的白色固体,换句话说,它很容易从环境中吸收水分。因此,在实验室里,它被用来从其他物质中吸收水分。
它极可溶于水,富有OH离子的碱性溶液。因此pH价值也很高。它的水溶液呈碱性,用于吸收各种工业过程中的酸性气体,例如二氧化碳和硫化氢。

K2CO3用于制备肥皂、清洁产品、洗衣粉和洗碗混合物。它也用于某些纺织纤维的加工,如羊毛。
它被广泛用于化学实验室,例如从其他化合物中吸收水分或碱化化学反应混合物,它也用于化学分析。
它也被添加到一些食物中,例如,以消除巧克力生产过程中可可豆的苦味。
结构碳酸钾由两个钾阳离子和一个碳酸根阴离子组成。碳酸根阴离子具有扁平对称结构,三个氧原子在碳周围形成一个扁平的三角形。
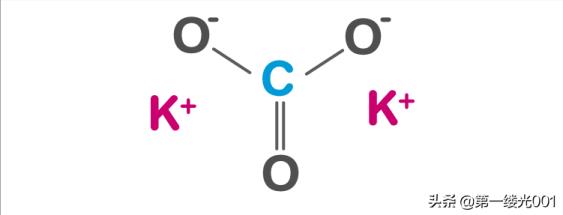
属性物理状态:无色至白色结晶固体。
分子量;138.205 g / mol。
熔点:899°C。
密度:2.29 g / cm3
溶解度:可溶于水:在25°c时111 g / 100 g水。不溶于乙醇和丙酮。
pH值:水溶液pH该值可以是11.6,换句话说,它是碱性的。
化学性质
碳酸钾易潮解或吸湿,也就是从环境中吸收水分,它有稳定的水合物。
它在水溶液中水解K2CO3,换句话说,它与水反应,释放出OH基团,即使溶液呈碱性的基团:
CO32- + H2O ? OH– + HCO3–
HCO3– + H2O ? OH– + H2CO3
获取它可以从燃烧植物留下的灰烬中获得。通过向氢氧化钾中加入过量的二氧化碳:
KOH + CO2 → KHCO3
2 KHCO3 + 热量→ K2CO3 + H2O
另一种方法是加入氯化钾(KCl)用碳酸镁(MgCO3)、水和二氧化碳在压力下被加热。首先,获得镁和钾的水合复盐MgCO3.KHCO3.4H2O,被称为恩格斯盐:
2 KCl + 3 MgCO3 + CO2 + 5 H2O → MgCO3.KHCO3.4H2O ↓ + MgCl2
恩格斯的水合复盐从溶液中沉淀并过滤出来。然后加热,加水溶解,碳酸镁MgCO3不溶,要移除的过滤器。
MgCO3.KHCO3.4H2O + 热量→ MgCO3↓ + 2K+ + CO32- + CO2↑ + 9 H2O
应用工业过程中二氧化碳的吸收
碳酸钾溶液是各种工艺中去除二氧化碳的经典处理方法,尤其是在高压和高温应用中。

CO2根据以下反应进行去除:
K2CO3 + CO2 + H2O ? 2 KHCO3
用于发电厂,避免将二氧化碳释放到大气中,并产生干冰。

它可以通过加热再生,也就是加热到100°C左右。
为了使碳酸钾溶液快速吸收CO2,加入二乙醇胺(DEA)异加速剂,吸收过程被加速。
在去除H2S在某些过程中
碳酸钾溶液也用于去除工艺流程中的硫化氢气体H2S。及时补充三磷酸钾,让这个过程更快。
在化学实验室
K2CO3允许有机合成,例如,在缩合反应和中和中。它用于从有机液体中除去水分,实验室中用作脱水剂或干燥剂。
它也用于分析制药工业中的化学反应和碱化。
在清洁产品行业中
K2CO3用来做肥皂、清洁配方、洗衣和洗碗产品,它还可以用于制备洗发水和其他个人护理产品。

在食品工业中
碳酸钾出于各种目的被添加到各种食物中。
例如,它被添加到可可豆中以消除其苦味,用来生产巧克力。在葡萄干燥过程中添加,去拿葡萄干。

在蛋糕里,它被用作面粉的膨松剂(扮演酵母的角色)准备烘烤食品。

在肥料中的应用
K2CO3用于酸性土壤的施肥,因为碳酸根离子——与水接触会产生OH离子——它会增加土壤pH值。再加上钾是植物的养分。
碳酸钾也被用来制造缓释肥料。
缓释肥缓慢释放养分,这样它们就不会溶解或被冲走。
其他应用
碳酸钾K2CO3也用于:-羊毛染色、纺织工业中的漂白和清洗过程及其他活动。-获得了其他有机和无机钾盐,如KCN氰化钾。-在各种过程中充当酸度调节剂。-制作陶器和陶器。-以及雕刻和光刻工艺。-皮革鞣制和涂饰。-准备印刷油墨,颜料。-电视特种眼镜的生产,因为K2CO3它比碳酸钠更容易与玻璃中的铅相容、钡和锶的氧化物是相容的。
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容,请发送邮件举报,一经查实,本站将立刻删除。
碳酸锌化学式(碳酸钾化学式)相关文章
2024-04-28
2024-04-28
2024-04-28
2024-04-28
2024-04-28
2024-04-28